

























生物等效性(BE)是国内外药物仿制的重要评价内容,也是药物制剂开发中颇具价值的评价指标。仿制药通过生物等效性研究可证明其与原研药具有生物等效性时,则可免去冗杂的临床前和临床研究,直接批准上市,这将大大降低医药研发的经费与时间成本。
而药物研究结果如BE试验等,在很大程度上依赖于准确、可靠、可重现的生物样本分析方法,因此,建立高质量的生物分析方法颇为关键。
生物样本分析有哪些成败关键要点?关于生物分析实验室又有哪些管理规范和关键性问题?
日前,W66国际医药子公司旭辉检测生物分析部总监张枢作客“W66国际研语”直播间,以《从生物分析角度看影响生物等效性的的几点因素》为题,向广大网友分享了关于生物样本分析的实验室管理方法、相关法规、影响分析准确性等方面的内容。
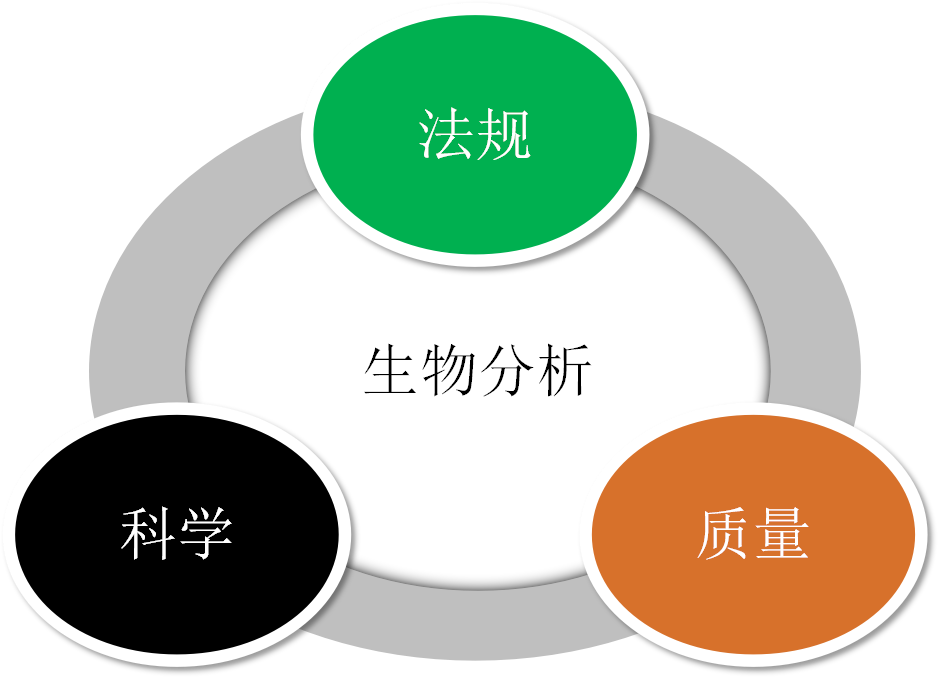
直播伊始,张枢就向广大网友强调了与生物分析息息相关的三个条件:法规、科学、质量。
张枢认为,生物等效性实验不同于一般的临床实验,它对结果、结论有着更为明确的指标要求。“法规可以规范实验操作,帮助实验数据更为准确可靠;科学作为生物分析实验的前提,提高了可信度;而质量则是重中之重,将直接影响分析结果和检测数据。”
随后,张枢重点介绍了生物分析实验室的规范管理。在她看来,实验室的规范管理将对生物分析结果的有效性和可靠性提供很大的帮助。“《药物临床试验生物样本分析实验室管理指南(试行)》对组织体系架构、人员职责、软硬件要求、过程管理和质量管理就作出了明确规范和要求。”

在谈到软硬件要求方面,张枢特别提到了权限设置和审计追踪。“权限设置对于计算机化系统甚至是整个项目核查来说是重中之重。关于人员权限的设置问题,将关系到数据能否被修正或改动,这直接影响到生物分析数据的真实性和准确性。审计追踪则是对整个实验项目进展的一个跟踪系统,根据审计追踪可以从侧面证实行进过程中的规范性以及各个流程的进度和状态,在项目核查过程中是一个颇为关注的点。”

除了对实验室管理规范作出细致解析外,张枢在直播还对生物样本分析法规进行了详尽的解读。

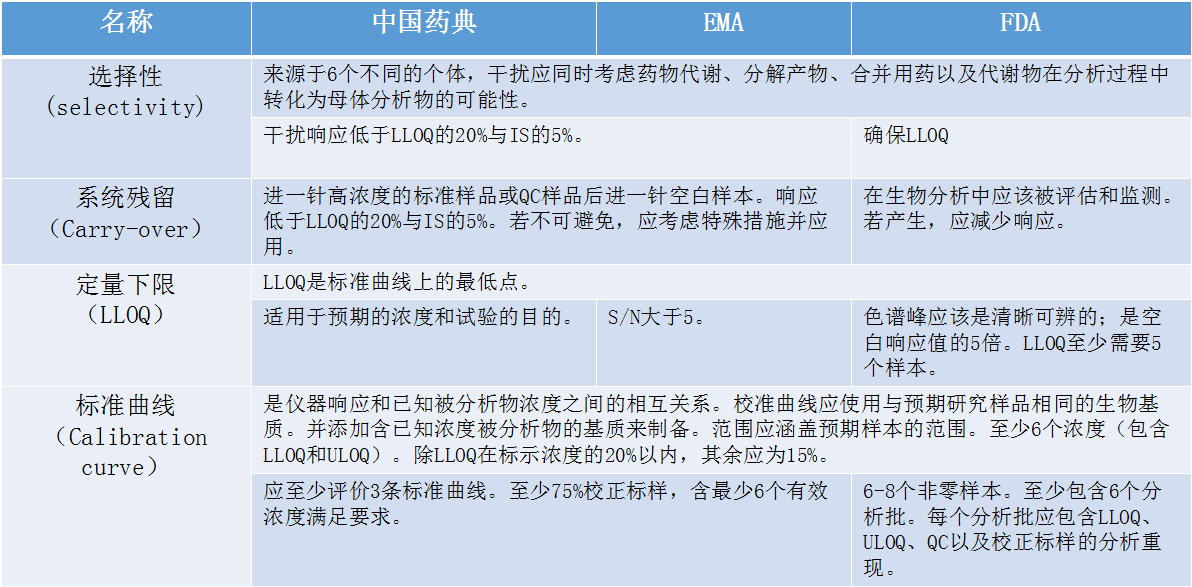
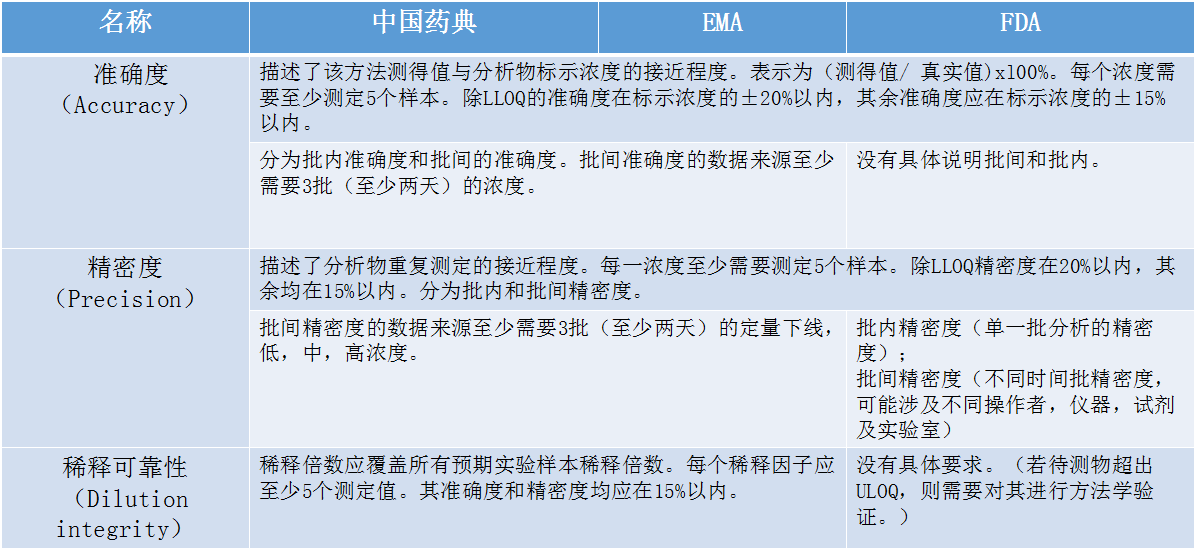
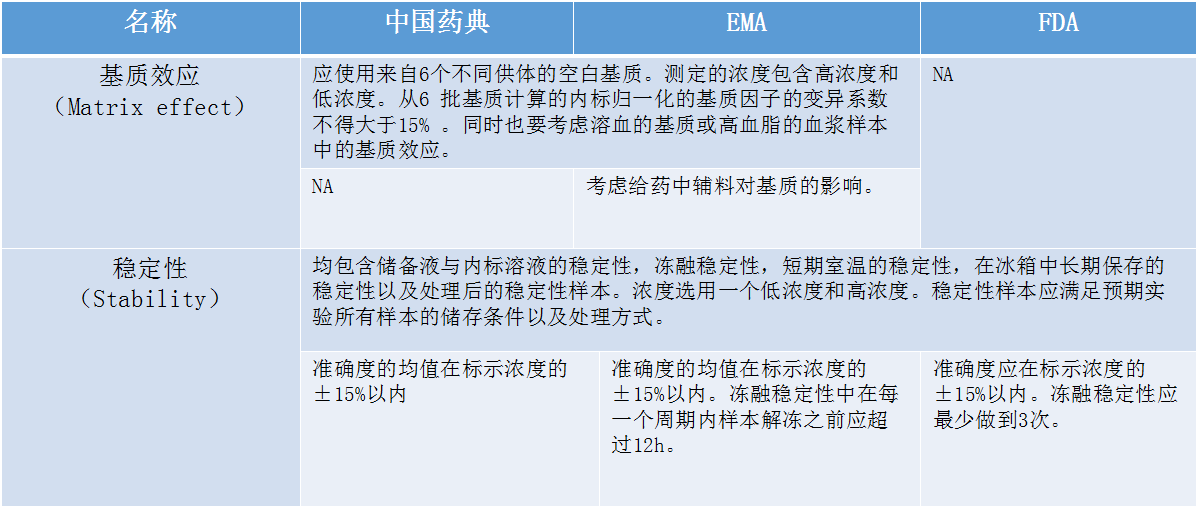
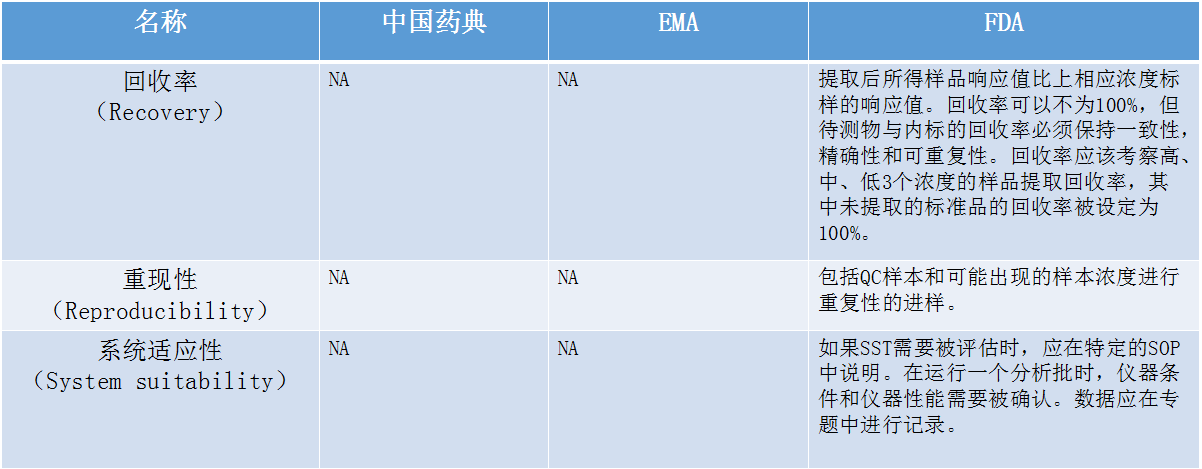
在介绍生物样本分析法规时,张枢特别提到了检测过程中经常遇到的系统残留的问题。张枢说:“在检测分析过程中,难免会遇到高浓度的样品,若高浓度的样品存在系统残留的话,很可能对下一步要检测的样品的浓度产生偏差,这将直接影响到后面涉及到的参数计算,进而影响到整个生物样本分析的结果和准确性。”
那么对于系统残留应该如何去考察和解决呢?
针对系统残留的问题,张枢也在直播中给出了自己的答案。“对于高浓度样品检测后存在的系统残留问题,通常会进一针高浓度的标准样品或QC样品,一般会选择标准曲线的最高点样品,然后再进一针空白样品,来考察这个空白样品的待测物残留情况如何。”
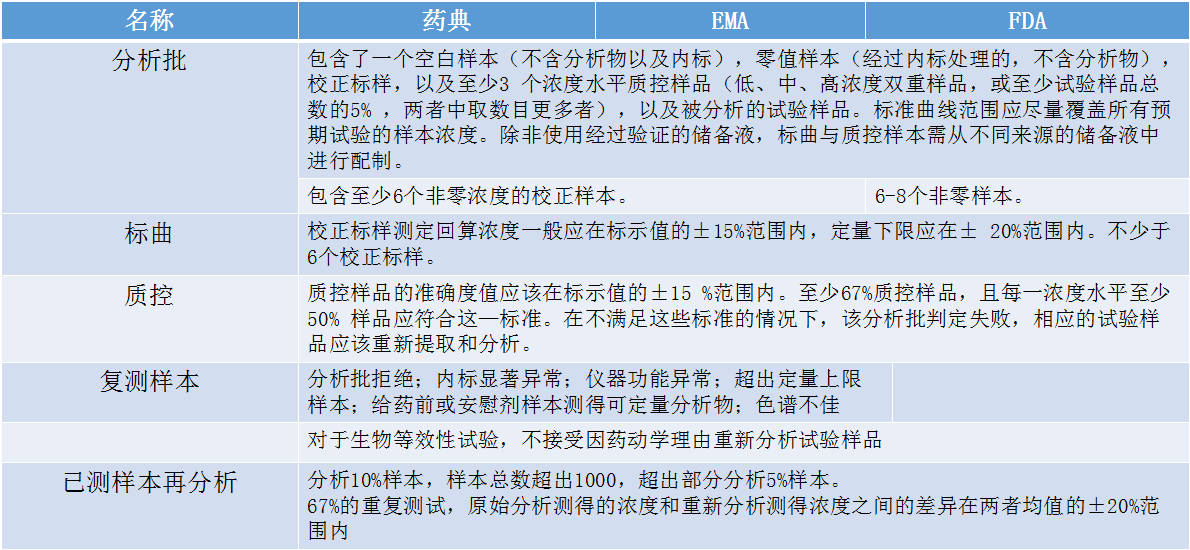
在样品分析的过程中,除了对一些分析方法验证内容的解读,还需了解一些技术指导标准。张枢顺势介绍了分析批、标曲、质控、复测样本和已测样本再分析。
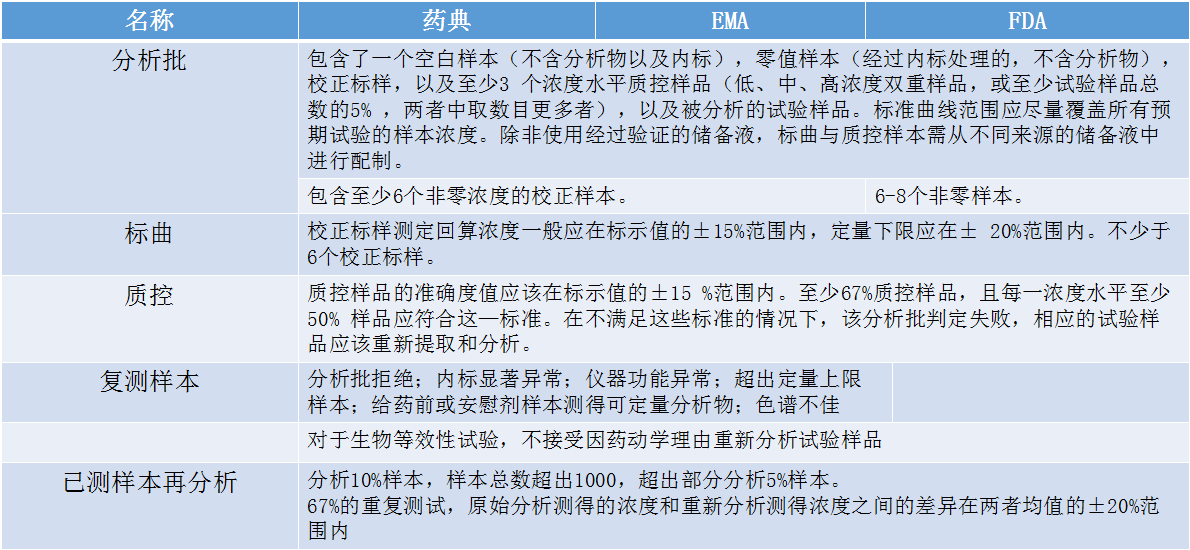
关于影响分析准确性的因素,张枢谈到了以下几点(包括但不限于)原因。

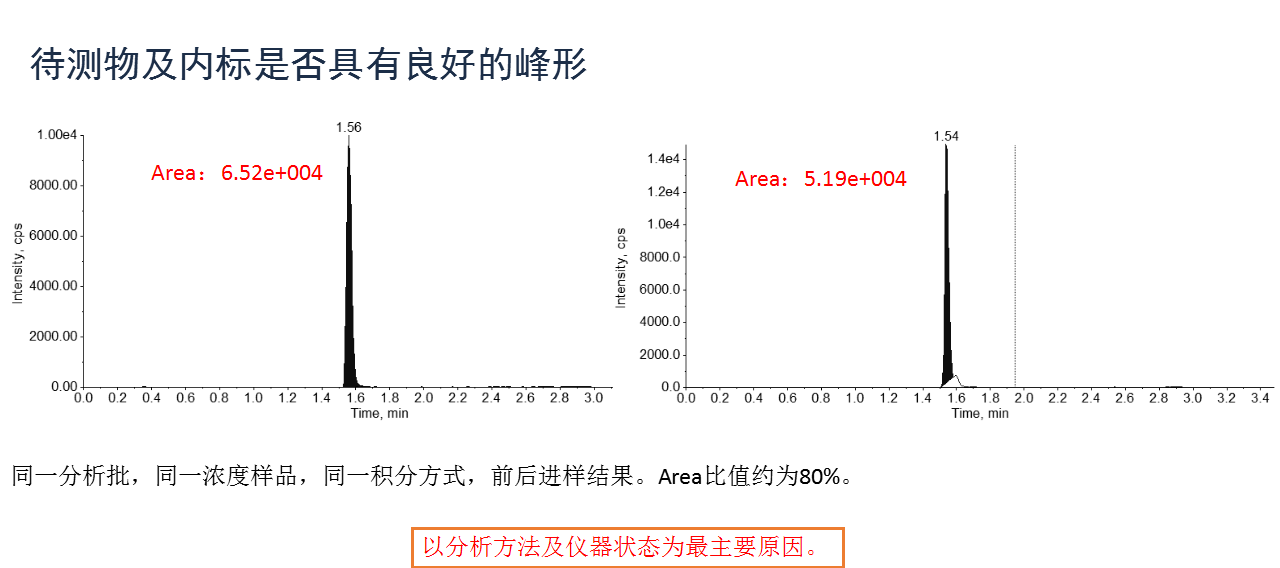


介绍完以上的主要内容,张枢在直播尾声也对本次直播课程进行了一次小结,也再次向广大网友强调了法规、科学、质量与生物分析法的密切关系。规范是确保数据的真实有效、科学合理的进行方法学验证是生物样品分析的前提、提高生物分析的质量是生物等效的重要决定因素之一,同时还指出要关注细节,每一个细节都可能对生物样品分析结果造成影响。